Premesse : il trattamento del dolore cronico mediante la stimolazione del midollo spinale (SCS) sub-percezionale non provoca parestesia ma è associato a un lungo “wash-in” analgesico (cioè durata fino al massimo sollievo dal dolore) ea una valutazione prolungata della terapia. Descriviamo il raggiungimento di risultati analgesici clinicamente significativi e ad insorgenza rapida utilizzando un nuovo approccio SCS di sub-percezione.
Metodi : Questa serie di casi osservazionali ha valutato i pazienti a cui era stato impiantato un dispositivo SCS per il dolore cronico, che sono stati sottoposti a riprogrammazione utilizzando una nuova metodologia in cui la parestesia è stata utilizzata per guidare il campo di stimolazione della sub-percezione mirato a parametri specifici, inclusi impulsi simmetrici con bilanciamento della carica a 90 Hz (denominata Terapia della subpercezione ad azione rapida, VELOCE). I punteggi del dolore (NRS) sono stati raccolti come riportato per standard di cura dalle cartelle dei pazienti.
Risultati : Il punteggio medio complessivo del dolore al basale era 8,4 ± 0,2 (n = 41). Dopo l’attivazione di FAST, è stata riportata una riduzione di 7,1 punti del punteggio complessivo del dolore (1,3 ± 0,2, p <0,0001) entro 11,2 ± 1,9 minuti (n = 34). Questa diminuzione del punteggio del dolore è stata mantenuta a 3 mesi (1,6 ± 0,3, n = 26) e 6 mesi di follow-up (1,7 ± 0,4, n = 18). All’ultimo follow-up (media = 223 ± 132 giorni), è stato determinato un punteggio del dolore di 1,6 ± 0,3, n = 30.
Conclusioni : Dopo l’implementazione FAST, è stata osservata una profonda risposta analgesica, che richiedeva sostanzialmente meno energia rispetto alle metodologie convenzionali di sub-percezione. Questa rapida insorgenza analgesica ottenuta con la nuova tecnica FAST suggerisce il potenziale per un meccanismo d’azione alternativo della SCS sub-percettiva.
1. Introduzione
La stimolazione del midollo spinale (SCS) basata sulla parestesia è stata utilizzata per decenni per il trattamento del dolore cronico. Storicamente, alcuni ritengono che l’attivazione antidromica delle fibre nervose nelle colonne dorsali sia in grado di “chiudere il cancello” con conseguente analgesia, mentre l’attivazione ortodromica provoca parestesie [ 1 ]. Si presumeva quindi che la relazione tra l’induzione della parestesia e l’analgesia fosse collegata poiché è stato dimostrato che la posizione del sollievo dal dolore è correlata alla sovrapposizione della parestesia [ 2]. Tuttavia, quasi 40 anni dopo l’inizio di SCS, Yearwood e Foster hanno descritto casi di SCS in cui l’analgesia è stata raggiunta ad ampiezze inferiori alla soglia di parestesia e ora esistono approcci SCS attuali che non producono parestesia, variamente descritti come “senza parestesia”, SCS “indipendente dalla parestesia” o “sottopercezione” [ 3–6 ]. È interessante notare che la SCS sub-percettiva produce un inizio più lento dell’analgesia dopo l’attivazione della stimolazione (in genere diverse ore o giorni) in contrasto con la SCS basata su parestesie in cui l’analgesia viene solitamente osservata in pochi minuti [ 7-10 ]. Ciò ha contribuito a varie ipotesi sui potenziali meccanismi d’azione che mediano il sollievo dal dolore prodotto da approcci basati sulla sub-percezione [ 10-12 ].
Nonostante queste domande meccanicistiche, le conseguenze per i pazienti di un prolungato tempo di “wash-in” (cioè la durata fino alla massima analgesia) e altri inconvenienti associati alle attuali metodologie di sub-percezione sono potenzialmente onerose. In particolare, è probabile che l’ottimizzazione del programma terapeutico sia prolungata (ad es. la valutazione di qualsiasi set di parametri richiede circa 1-2 giorni) oltre che tecnicamente compromessa (ossia il numero di impostazioni di programmazione che possono essere testate in pratica è limitato) [ 9 , 11]. A causa di queste proprietà, i pazienti che utilizzano le tecniche convenzionali di sub-percezione in genere non ricevono sollievo dal dolore durante la visita di programmazione e l’efficacia del trattamento non può essere immediatamente assicurata. Inoltre, i metodi che forniscono SCS di sub-percezione a frequenze più elevate (ad es. 1–10 kHz) richiedono spesso più energia e richiedono ricariche più frequenti [ 9 , 10 ].
In studi precedenti, abbiamo dimostrato che la sottopercezione SCS può essere efficace utilizzando frequenze fino a 10 Hz e quando le soglie di percezione sono state testate in pazienti valutati in queste analisi, l’area del loro dolore è stata talvolta osservata sovrapposta alla loro sensazione di parestesia. 9 , 13 ]. Questo ci ha spinto a considerare se la parestesia, come risposta fisiologica indicativa dell’organizzazione spinale, potesse servire come marker per il targeting di SCS sottopercezione [ 14]. Per valutare ulteriormente ciò, abbiamo guidato la parestesia ad alta risoluzione (~ 300 µm) su elettrocateteri ravvicinati a una frequenza di 90 Hz utilizzando un’ampiezza di impulso (210 ± 50 µs; efficace per SCS sub-percezione a bassa frequenza) e al minimo ampiezza pratica in grado di indurre parestesie con una completa sovrapposizione delle aree del dolore [ 13 , 15]. Inaspettatamente, quando l’ampiezza è stata ridotta al di sotto della soglia di percezione, è stato osservato che la maggior parte dei pazienti ha ottenuto sollievo dal dolore entro pochi minuti dall’attivazione della terapia SCS. Alla luce di queste osservazioni iniziali, abbiamo ipotizzato la possibilità di un diverso meccanismo d’azione rispetto a quello che è stato classicamente proposto come il meccanismo plausibile alla base della sottopercezione SCS e abbiamo cercato di valutare un numero ampliato di pazienti utilizzando questa nuova metodologia che d’ora in poi chiamiamo Terapia della sub-percezione ad azione rapida (FAST). Qui, forniamo prove precoci dei risultati della terapia FAST sulla base delle nostre osservazioni su 41 pazienti impiantati con SCS che hanno utilizzato FAST per il trattamento del dolore cronico alla schiena e/o alle gambe.
2. Pazienti e metodi
2.1. Progettazione dello studio
Questa serie di casi osservazionali multicentrici (Clinicaltrials.gov ID: NCT01550575) è stata effettuata sulla base di una revisione retrospettiva della cartella di 41 pazienti consecutivi a cui era stato precedentemente impiantato ‘on-label’ (cioè approvato dalla FDA) con un sistema SCS permanente (Spectra WaveWriter/ Precision Spectra, Boston Scientific, Valencia, CA) che utilizzano elettrocateteri con un massimo di 32 elettrodi a distanza ravvicinata (~1 mm da bordo a bordo; InfinionCX/LinearST/CoverEdge, Boston Scientific) per il trattamento del dolore cronico della parte bassa della schiena e/o arti inferiori. In questo studio sono stati inclusi i pazienti che hanno utilizzato la terapia di sub-percezione ad azione rapida (FAST) per gestire il loro dolore.
L’approvazione dell’Institutional Review Board (IRB) è stata ottenuta da ciascun sito e studio dall’IRB occidentale (Numero di riferimento: WIRB/20120371) e lo studio è stato condotto in conformità con le linee guida sulle buone pratiche cliniche (ISO14155) e la Dichiarazione di Helsinki.
2.2. Metodologia VELOCE
A tutti i pazienti è stato chiesto di spegnere il proprio sistema SCS per almeno 12 ore prima della sessione di riprogrammazione SCS, secondo lo standard di cura (come applicabile ai centri partecipanti). I pazienti avevano precedentemente ricevuto un sistema SCS che consentiva il controllo multiplo di corrente indipendente (MICC), ovvero ogni elettrodo sull’elettrocatetere ha la propria sorgente di corrente dedicata e il sistema è dotato di un algoritmo di programmazione basato su modello che consente più punti centrali di stimolazione ( CPS) da spostare simultaneamente rostrocaudalmente e mediolateralmente ad alta risoluzione (passi di ~300 µm) [ 15 , 16]. I pazienti inclusi in questa analisi retrospettiva sono stati programmati utilizzando una frequenza di 90 Hz e un’ampiezza dell’impulso di 210 ± 50 µs con una forma d’onda bifasica simmetrica. Utilizzando forme d’onda bifasiche simmetriche, nel paradigma di stimolazione vengono implementati due CPS separati, uno per ciascuna fase rettangolare del ciclo di stimolazione con bilanciamento della carica. Durante la prima fase rettangolare della forma d’onda di stimolazione bifasica, la corrente negativa viene iniettata attraverso contatti configurati negativamente (“catodi”) e la corrente positiva viene iniettata attraverso contatti di ritorno configurati positivamente (“anodi”). Durante la seconda fase rettangolare, le polarità vengono invertite per ottenere l’equilibrio di carica (cioè la corrente è anodica al catodo assegnato e viceversa) implementando così un secondo CPS nella regione anodica ( Figura 1). Le impostazioni sono state selezionate in base a uno studio precedente, in base allo standard di cura, che ha identificato le combinazioni di frequenza dell’ampiezza dell’impulso efficaci per la sottopercezione SCS e la selezione di 90 Hz per la mappatura fisiologica (parestesie) [ 13 ]. Gli elettrocateteri sono stati posizionati utilizzando una tecnica standard secondo la preferenza del medico impiantatore all’interno dell’intervallo tipico delle vertebre T7-T10. Per identificare la configurazione dell’elettrodo e mettere a punto la posizione della stimolazione, è stata eseguita una ricerca del target neurale utilizzando due CPS (distanti tra 8 e 16 mm) guidati contemporaneamente (vedi Figura 1 ) nelle dimensioni rostro-caudale e mediale-laterale utilizzando il impostazione della risoluzione “fine” dell’algoritmo (spostamenti abilitati del campo di neurostimolazione con incrementi di ~300 µm) [ 15]. Inoltre, la diffusione della parestesia durante il targeting è stata controllata modulando la distanza tra anodi e catodi da 8 a 16 mm. Questo metodo ha consentito un’ottimizzazione sistematica del campo stimolante che ha fornito una sovrapposizione completa tra l’area del dolore e la sensazione di parestesia con un’ampiezza appena al di sopra della soglia di percezione, e dove tale sovrapposizione è stata mantenuta sotto varie posture del corpo e attività fisiche comuni (es. camminare, muovere gli arti) . L’ampiezza è stata quindi ridotta a circa il 65% della soglia di percezione. Nella nostra esperienza, esiste una gamma e una variabilità nel livello di intensità della terapia efficace per un dato soggetto, pertanto tutti i pazienti sono stati incoraggiati a valutare un livello di intensità diurno (40–70%) e uno notturno (20–40%) da tenere in considerazione per la postura e l’attività fisica. Tutti i pazienti hanno comunicato verbalmente di aver utilizzato il loro controller esterno per regolare i valori di intensità entro un intervallo compreso tra il 20 e il 70% della soglia di percezione, come raccomandato (l’ampiezza minima era bloccata al 10% e la massima era bloccata al 100% della soglia di percezione) per l’indagine quali valori all’interno di questo intervallo hanno fornito il miglior sollievo dal dolore. Ampiezze più basse sono state raccomandate per l’uso durante il sonno e ampiezze più elevate per attività fisicamente più intense. Tutti gli altri parametri di stimolazione (ad es. frequenza, larghezza dell’impulso) sono stati bloccati. Ampiezze più basse sono state raccomandate per l’uso durante il sonno e ampiezze più elevate per attività fisicamente più intense. Tutti gli altri parametri di stimolazione (ad es. frequenza, larghezza dell’impulso) sono stati bloccati. Ampiezze più basse sono state raccomandate per l’uso durante il sonno e ampiezze più elevate per attività fisicamente più intense. Tutti gli altri parametri di stimolazione (ad es. frequenza, larghezza dell’impulso) sono stati bloccati.
Figura 1. Targeting submillimetrico con elettrodi ravvicinati e più sorgenti di corrente(a) Illustrazione ingrandita di doppi elettrocateteri percutanei (1 x 16) in posizione tipica T7-T9 (vedi riquadro) e con catodi attivi (verde) e anodi (viola) che affondano/alimentano varie percentuali (numeri sugli elettrodi) del totale attuale. Un algoritmo di guida del campo basato su modello utilizza le molteplici sorgenti di corrente indipendenti per assegnare correnti specifiche in un modo che genera un catodo virtuale (‘A’ verde) e un anodo virtuale (‘A’ viola) [ 15]. (b) Le forme d’onda bifasiche-simmetriche producono più punti di stimolazione. Esempio illustrativo di forme d’onda bifasiche simmetriche a 90 Hz (frequenza) e 200 µs (ampiezza dell’impulso) generate sugli elettrodi fisici E4, E7, E20 ed E23. Durante la prima fase rettangolare della forma d’onda di stimolazione bifasica, viene iniettata corrente negativa attraverso contatti configurati negativamente (“catodi”, verde, 27%+17%+31%+17%+8% = 100%) e viene iniettata corrente positiva tramite contatti di ritorno configurati positivamente (‘anodi’, viola, 22%+13%+37%+22%+6% = 100%). Durante la seconda fase rettangolare, l’equilibrio di carica si ottiene invertendo le polarità (cioè la corrente è anodica al catodo assegnato e viceversa). Notare le diverse ampiezze di corrente su diversi elettrodi abilitati da più sorgenti di corrente e utilizzati per la messa a punto della posizione di stimolazione.
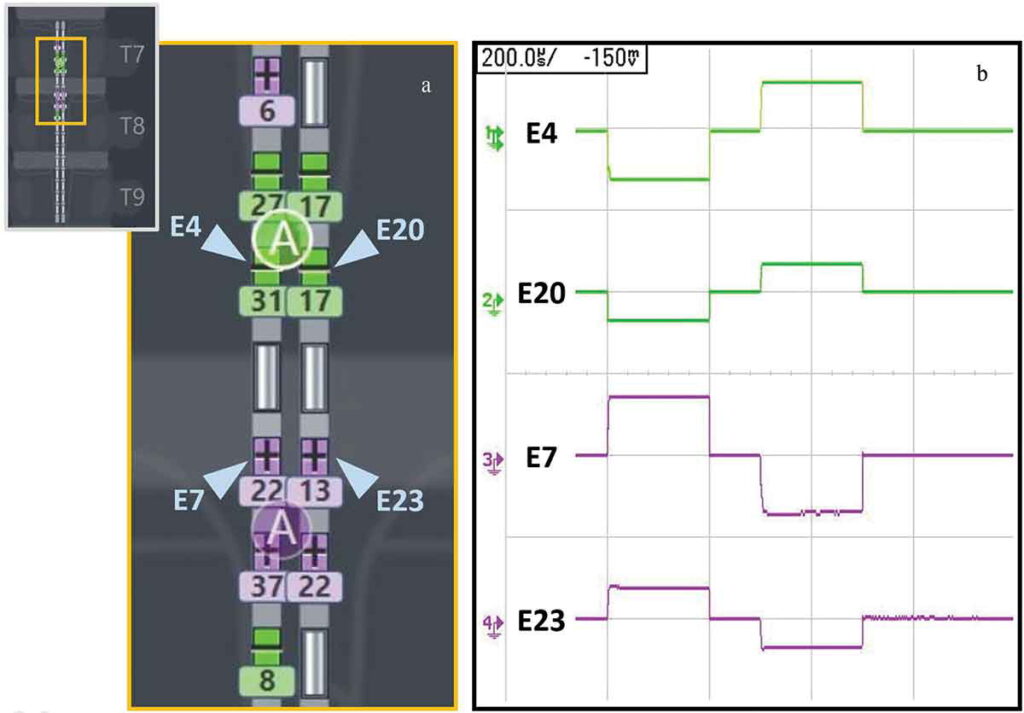
(a) Illustrazione ingrandita di doppi elettrocateteri percutanei (1 x 16) in posizione tipica T7-T9 (vedi riquadro) e con catodi attivi (verde) e anodi (viola) che affondano/alimentano varie percentuali (numeri sugli elettrodi) del totale attuale.
Un algoritmo di guida del campo basato su modello utilizza le molteplici sorgenti di corrente indipendenti per assegnare correnti specifiche in un modo che genera un catodo virtuale (‘A’ verde) e un anodo virtuale (‘A’ viola) [
15].
(b) Le forme d’onda bifasiche-simmetriche producono più punti di stimolazione.
Esempio illustrativo di forme d’onda bifasiche simmetriche a 90 Hz (frequenza) e 200 µs (ampiezza dell’impulso) generate sugli elettrodi fisici E4, E7, E20 ed E23.
Durante la prima fase rettangolare della forma d’onda di stimolazione bifasica, viene iniettata corrente negativa attraverso contatti configurati negativamente (“catodi”, verde, 27%+17%+31%+17%+8% = 100%) e viene iniettata corrente positiva tramite contatti di ritorno configurati positivamente (‘anodi’, viola, 22%+13%+37%+22%+6% = 100%).
Durante la seconda fase rettangolare, l’equilibrio di carica si ottiene invertendo le polarità (cioè la corrente è anodica al catodo assegnato e viceversa).
Notare le diverse ampiezze di corrente su diversi elettrodi abilitati da più sorgenti di corrente e utilizzati per la messa a punto della posizione di stimolazione.
2.3. Raccolta e analisi dei dati
I dati relativi alla demografia, alla storia medica e alla posizione del dolore sono stati raccolti come parte della revisione del grafico. I punteggi del dolore (NRS) relativi al dolore generale, alla parte bassa della schiena e/o al dolore alle gambe sono stati raccolti dal personale del sito come parte del loro standard di cura e del follow-up di routine. Queste informazioni sono state successivamente inserite dal personale del sito nella banca dati elettronica progettata per la raccolta dei dati dello studio. Per ridurre al minimo i potenziali bias, la raccolta dei dati è stata eseguita direttamente dal personale del sito clinico senza il coinvolgimento dello sponsor. Tutti i dati sono stati raccolti dal personale del sito nell’ambito delle cure di routine, sia prima della riprogrammazione con FAST che al termine della visita. Il tempo in cui la stimolazione è stata disattivata è stato registrato interrogando ciascun paziente prima dell’inizio della sessione di programmazione FAST. Inoltre, è stato registrato il tempo di attivazione dello specifico programma FAST utilizzato per la terapia. A causa della natura retrospettiva di questo studio, non è stato definito alcun protocollo prestabilito per misurare il tempo di insorgenza dell’analgesia specifica dopo l’attivazione del programma FAST. Tuttavia è stata calcolata la differenza temporale tra l’attivazione del programma FAST utilizzato per la terapia e la registrazione del punteggio del dolore NRS al termine della visita (attivazione post-FAST). Per determinare il consumo di energia, la carica media al secondo (millicoulomb al secondo di carica erogata durante la prima fase dell’impulso di stimolazione) è stata calcolata in base a quanto segue: ampiezza (mA) × larghezza dell’impulso (μs) × frequenza SCS (Hz). I dati dello studio raccolti ai punti temporali di 3 e 6 mesi sono stati derivati solo da pazienti che al momento dell’istantanea dei dati avevano raggiunto queste visite di follow-up. Quindi, il numero ridotto di quelli analizzati a 3 e 6 mesi si è verificato solo perché non tutti i 41 pazienti originali inclusi all’inizio di questo studio avevano raggiunto questi tempi di follow-up e non a causa di dati mancanti o persi da seguire -su. Le statistiche descrittive sono state utilizzate per definire le caratteristiche della popolazione (media, deviazione standard [DS] o errore standard [SE]). Per valutare le differenze sono stati utilizzati il t-test accoppiato o il test dei ranghi con segno di Wilcoxon e i valori P di 0,05 sono stati considerati statisticamente significativi. La normalità della distribuzione è stata valutata sulla base dei grafici e del test di Kolmogorov-Smirnov. Le statistiche descrittive sono state utilizzate per definire le caratteristiche della popolazione (media, deviazione standard [DS] o errore standard [SE]). Per valutare le differenze sono stati utilizzati il t-test accoppiato o il test dei ranghi con segno di Wilcoxon e i valori P di 0,05 sono stati considerati statisticamente significativi. La normalità della distribuzione è stata valutata sulla base dei grafici e del test di Kolmogorov-Smirnov. Le statistiche descrittive sono state utilizzate per definire le caratteristiche della popolazione (media, deviazione standard [DS] o errore standard [SE]). Per valutare le differenze sono stati utilizzati il t-test accoppiato o il test dei ranghi con segno di Wilcoxon e i valori P di 0,05 sono stati considerati statisticamente significativi. La normalità della distribuzione è stata valutata sulla base dei grafici e del test di Kolmogorov-Smirnov.
3. Risultati
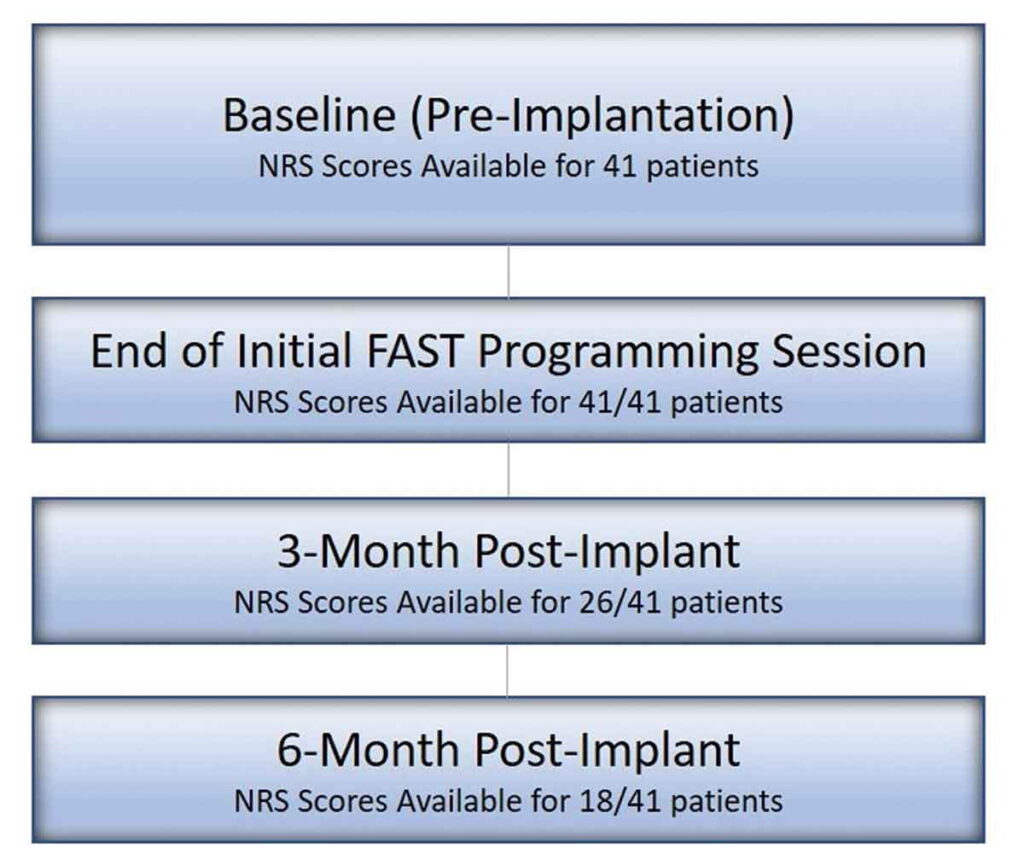
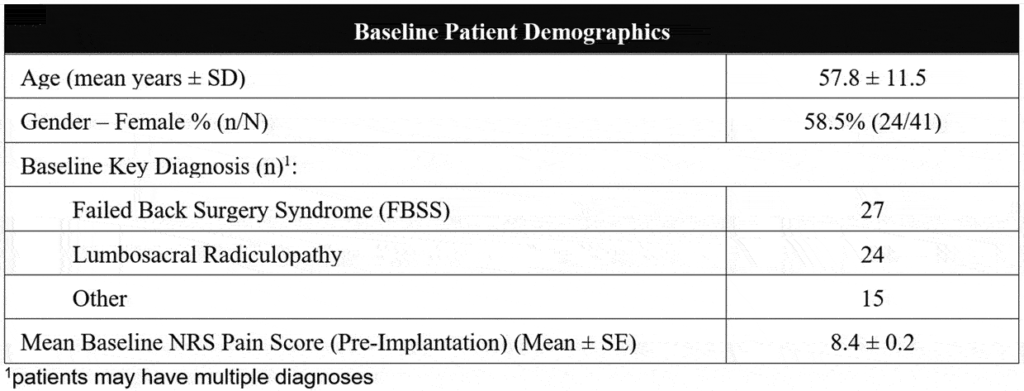
Un totale di 41 pazienti impiantati in modo permanente (numero medio di giorni impiantati: 184) sono stati identificati e analizzati al basale e alla pre/post-attivazione di FAST. Di questi, 26 hanno raggiunto il follow-up di 3 mesi e 18 hanno raggiunto la visita di follow-up di 6 mesi, come mostrato nella Figura 2 . La Tabella 1 mostra i dati demografici di base del paziente. In sintesi, l’età media dei pazienti era di 57,8 ± 11,5 anni prima dell’impianto e il 58,5% dei pazienti era di sesso femminile. La maggior parte dei pazienti ha ricevuto SCS per le indicazioni di Sindrome da Chirurgia della schiena fallita e/o radicolopatia lombosacrale (diagnosi chiave riportata nella Tabella 1 ). I pazienti sono stati impiantati utilizzando una varietà di derivazioni disponibili; tuttavia, tutti gli elettrocateteri impiantati erano dotati di contatti ravvicinati con una spaziatura rostro-caudale di circa 1 mm.
I punteggi complessivi del dolore NRS pre-impianto al basale erano disponibili per tutti i pazienti valutati (n = 41) e la NRS media al basale era 8,4 ± 0,2 ( Tabella 1 ). Prima dell’attivazione di FAST e nello stato di stimolazione OFF, il punteggio complessivo medio del dolore NRS era 6,5 ± 0,3 ( Figura 2(a)). Dopo l’attivazione di FAST, il dolore complessivo è stato ridotto di una media di 7,1 ± 0,4 punti (rispetto al basale pre-impianto) e 5,2 ± 0,3 punti (rispetto all’attivazione pre-FAST) a 1,3 ± 0,2 (n = 41, p <0,0001). Rispetto al pre-FAST (stim OFF), un miglioramento NRS del dolore generale di 4,8 ± 0,4 (n = 26, p <0,0001) e 4,9 ± 0,5 (n = 18, p <0,0001) è stato notato a 3 e 6- mesi, rispettivamente. La natura retrospettiva di questo studio non offriva i mezzi per fornire una misurazione esatta del tempo di lavaggio. Tuttavia, in ciascun paziente è stata registrata la differenza temporale tra il tempo di fine visita (in cui è stato registrato il punteggio del dolore NRS) e il momento dell’attivazione iniziale del programma FAST (utilizzato per la terapia). È stata osservata una media di 11,2 ± 1,9 minuti (n = 34) che dimostra che i pazienti riportavano punteggi di dolore bassi (1,3 ± 0.Figura 3(d )). Questo intervallo di tempo medio rappresenta quindi un probabile valore limite superiore del tempo effettivo di insorgenza dell’analgesico, il che fornisce la prova iniziale che il sollievo dal dolore basato sulla sub-percezione utilizzando FAST può essere ottenuto all’interno di una singola visita di programmazione. I dati NRS sul dolore complessivo medio ai punti temporali del follow-up suggeriscono che l’entità dell’analgesia indotta da FAST osservata durante la visita di programmazione iniziale è stata mantenuta con successo a 3 e 6 mesi (p <0,0001) ( Figura 4 (a )). All’ultimo follow-up (media = 223 ± 132 giorni), è stato notato anche un punteggio del dolore di 1,6 ± 0,3, n = 30. Inoltre, è stato riscontrato che il dolore medio alla schiena NRS e il solo dolore medio alle gambe NRS dimostrano una tendenza simile ( Figure 3(b,c) e Figura 4(b,c)). La carica media calcolata al secondo utilizzando FAST (assumendo il 65% della soglia di percezione) è stata determinata in 0,05 ± 0,01 mC/s ( Figura 4(d )).
Figura 3. Riduzione del dolore durante la sessione di programmazione iniziale utilizzando FASTAttivazione pre-FAST (barre rosse; n = 41): NRS prima dell’inizio della sessione di programmazione (≥12 ore di nessuna stimolazione a dispositivo spento). Attivazione post-FAST (barre blu; n = 41): NRS misurata dopo l’attivazione della stimolazione FAST. (a) Dolore generale medio (b) Dolore alla schiena medio (c) Dolore alle gambe medio [1 paziente incluso in questa coorte non ha riportato dolore alle gambe] (d) Distribuzione degli intervalli di tempo tra l’attivazione della terapia FAST e la registrazione del dolore (n = 34; i dati sull’intervallo di tempo erano disponibili solo per 34 dei 41 pazienti totali valutati durante la sessione di programmazione FAST). Le barre di errore indicano un errore standard. La differenza significativa (p < 0,0001) da Pre-FAST stim off è indicata da un asterisco.
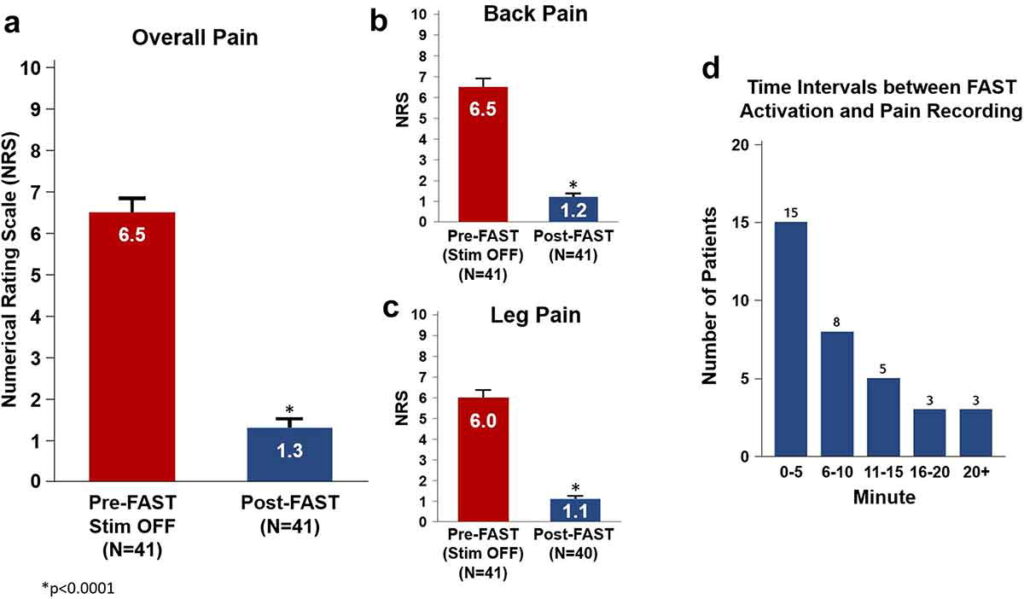
Attivazione pre-FAST (barre rosse; n = 41): NRS prima dell’inizio della sessione di programmazione (≥12 ore di nessuna stimolazione a dispositivo spento).
Attivazione post-FAST (barre blu; n = 41): NRS misurata dopo l’attivazione della stimolazione FAST.
(a) Dolore generale medio (b) Dolore alla schiena medio (c) Dolore alle gambe medio [1 paziente incluso in questa coorte non ha riportato dolore alle gambe] (d) Distribuzione degli intervalli di tempo tra l’attivazione della terapia FAST e la registrazione del dolore (n = 34; i dati sull’intervallo di tempo erano disponibili solo per 34 dei 41 pazienti totali valutati durante la sessione di programmazione FAST).
Le barre di errore indicano un errore standard.
La differenza significativa (p < 0,0001) da Pre-FAST stim off è indicata da un asterisco.
4. Discussione
A nostra conoscenza, questo è il primo rapporto di una serie di casi osservazionali multicentrici a descrivere un significativo sollievo dal dolore con insorgenza rapida utilizzando una metodologia SCS di sub-percezione, ora designata come Terapia di sub-percezione ad azione rapida (FAST). È importante sottolineare che l’entità di questo sollievo dal dolore rapidamente indotto è stata mantenuta fino al follow-up di 3 e 6 mesi o fino all’ultimo follow-up dei pazienti. Inoltre, in questo studio abbiamo determinato che FAST ha dimostrato una quantità di dispendio energetico relativamente inferiore rispetto a quella precedentemente riportata utilizzando la sub-percezione convenzionale a 1–10 kHz [ 9]. Sulla base della nostra esperienza, la capacità di ottenere sistematicamente analgesia ad azione rapida utilizzando una forma d’onda bifasica-simmetrica (cioè recupero attivo/ricarica attiva) a 90 Hz costituisce una nuova osservazione in quanto si riferisce all’applicazione clinica del SCS di sub-percezione.
La parestesia è un effetto generalmente osservabile della SCS come tradizionalmente applicato a bassa frequenza (<100 Hz), e la sua corrispondenza con l’area dolorosa è stata storicamente considerata un obiettivo desiderabile per tale terapia SCS sulla base della convinzione che la sovrapposizione della parestesia con la topografia del dolore si realizzi impegno con circuiti funzionalmente rilevanti secondo la classica teoria del “controllo del gate” tramite l’attivazione della fibra Aβ antidromica [ 1 , 2 , 14 , 17]. Tuttavia, questo vantaggio sembra essere perso utilizzando i metodi SCS convenzionali di sub-percezione, risultando in un processo di selezione degli elettrodi “prova ed errore” che richiede tempo durante la programmazione del dispositivo. Sorprendentemente, FAST è stato scoperto durante il tentativo di valutare se la parestesia, identificata utilizzando più punti centrali di stimolazione guidati simultaneamente ad alta risoluzione (rostrocaudale e mediolateralmente), potesse essere una risposta fisiologica efficace per l’uso nell’identificazione del sito o dei siti ottimali a cui applicare la sottopercezione SCS.
Le ipotesi proposte che cercano di chiarire i meccanismi d’azione (MOA) alla base degli effetti antidolorifici di SCS sono ancora generalmente in evoluzione e le osservazioni cliniche associate agli approcci SCS convenzionali di sub-percezione hanno sollevato ulteriori domande meccanicistiche [ 18 , 19 ]. In particolare, tempi di insorgenza dell’analgesico più lenti, maggiori grandezze di energia applicata e ampiezze terapeutiche molto basse sono aspetti che suggeriscono che altri bersagli e meccanismi con costanti di tempo più lunghe sono probabilmente coinvolti nella mediazione dei risultati associati all’uso delle tecniche convenzionali di sub-percezione [ 18 –20]. Le nostre osservazioni in seguito all’attivazione di FAST sembrano fornire nuove possibilità meccanicistiche che suggeriscono che i presunti meccanismi ad azione rapida possono essere coinvolti a livelli di ampiezza di sub-percezione ea energie relativamente basse. Pertanto, le ipotesi esaurienti sui meccanismi candidati che governano le capacità terapeutiche della sottopercezione SCS devono ora incorporare e/o sintetizzare sia modelli ad azione rapida (come gli effetti neurali diretti) sia modelli ad azione lenta (ad esempio modulazione sistemica, trascrizione genica, traduzione, o percorsi coordinati delle cellule gliali). Inoltre, l’osservazione che l’analgesia sub-percettiva ad azione rapida può essere ottenuta sistematicamente utilizzando una metodologia di targeting basata sulla fisiologia suggerisce che questi effetti provocati dipendono dalla posizione precisa della neurostimolazione applicata.
A questo proposito, di particolare recente interesse è il potenziale coinvolgimento di un meccanismo noto come ‘inibizione del circondamento’, che può avvenire attraverso l’attivazione elettrica di fibre Aβ o colonne dorsali originate da campi ricettivi immediatamente circostanti la sede del dolore. Questa attivazione a sua volta porta all’attivazione sinaptica di interneuroni inibitori che sopprimono la trasmissione delle informazioni nocicettive trasmesse dai circuiti spinali corrispondenti al centro del dolore – ma, contrariamente alla teoria del controllo del gate, senza eccitare il neurone centrale WDR [ 21 , 22 ].]. L’attivazione dell’inibizione del contorno da parte di FAST offre un MOA promettente per la terapia, poiché l’impegno selettivo delle colonne dorsali dal contorno può superare gli effetti eccitatori dell’attivazione delle colonne dorsali provenienti dal centro – inibizione che non sarebbe possibile mediante la stimolazione del solo centro del dolore [ 23 ]. È interessante notare che la recente modellazione computazionale preliminare suggerisce che la cattura di meno fibre della colonna dorsale di quella necessaria per la parestesia può comunque inibire il neurone di proiezione nocicettivo centrale tramite interneuroni inibitori se quelle fibre della colonna dorsale provengono principalmente dal campo ricettivo circostante e questo effetto non potrebbe essere riprodotto se le fibre della colonna dorsale centrale erano preferenzialmente mirate [ 24 ].
I gruppi che utilizzano altre modalità hanno utilizzato la guida della parestesia per ottenere una misura di sollievo dal dolore sub-percezionale ad azione lenta [ 6 , 25 ]. Tuttavia, altre indagini hanno indicato che la parestesia potrebbe non essere un requisito o utile per identificare un target di stimolazione della sub-percezione [ 26 , 27 ]. In quest’ultimo studio di De Carolis et al., in cui è stata messa in dubbio l’utilità della guida alla parestesia, è stata valutata la parestesia nella sede dell’efficace sottopercezione SCS con parametri molto diversi (60 Hz, ~470 µs) rispetto a quelli utilizzati per la terapia ( 10 kHz, 30–40 µs). Tuttavia, secondo rapporti precedentemente pubblicati, è improbabile che grandi cambiamenti nella frequenza e nell’ampiezza dell’impulso coinvolgano gli stessi elementi neurali [ 27–29]. Inoltre, esistono differenze molto notevoli tra il modo in cui SCS è stato implementato utilizzando FAST in questo studio e il modo in cui è stata valutata la parestesia in De Carolis et al., tra cui quanto segue:
- il posizionamento ad alta risoluzione del campo elettrico stimolante è stato consentito utilizzando elettrodi ravvicinati (~ 1 mm), un’architettura a più sorgenti di corrente (MICC) e un algoritmo (utilizzando una forma d’onda simmetrica bifasica) che può spostare in modo incrementale la stimolazione con incrementi di ~ 300 µm ( Figura 1 ) [ 15 ].
- le impostazioni di frequenza (90 Hz) e ampiezza dell’impulso (210 ± 50 µs) sono state applicate in natura sia per la mappatura fisiologica che per la terapia sulla base della valutazione preliminare delle impostazioni dei parametri ritenute efficaci per la sub-percezione [ 13 ].
- larghezze di impulso più brevi sono state utilizzate per la mappatura fisiologica (210 ± 50 µs contro 470 µs) e queste probabilmente producono una mappa più precisa [ 28 , 29 ].
Uno studio di modelli matematici di Lee et al. suggerisce che una maggiore attivazione delle fibre più piccole si verificherebbe all’aumentare della larghezza dell’impulso [ 29 ]. Poiché vi è una maggiore frazione relativa di fibre più piccole negli aspetti mediali delle colonne dorsali, i risultati della modellazione predicerebbero una maggiore copertura della parestesia nei dermatomi lombari e sacrali con una maggiore larghezza del polso [ 14 ]. In uno studio clinico complementare, Yearwood et al. ha mostrato che una maggiore larghezza dell’impulso può effettivamente portare al reclutamento di dermatomi più caudali e una maggiore copertura complessiva della parestesia [ 28]. L’effetto di modifica della parestesia dell’aumento della larghezza dell’impulso sembra essere un “orientamento delle fibre”, per cui l’uso di una larghezza dell’impulso più ampia consente di reclutare fibre più piccole e più mediali insieme o prima di fibre più grandi e laterali. A larghezze di impulso relativamente brevi (come usato in FAST) lo spostamento caudale e la ‘ricaduta’ complessiva della stimolazione dermatomale sono limitati e come postulato da Veizi et al. un algoritmo di targeting neurale consente il posizionamento preciso del campo di stimolazione sulle aree dolorose/sweet spot specifiche del paziente [ 15 ]. Inoltre, la possibilità di regolare la spaziatura tra i due CPS può aumentare ulteriormente la precisione e la specificità del targeting regolando il rapporto tra la soglia della radice dorsale e la soglia della colonna dorsale.
In questa prima valutazione, è stato osservato che l’utilizzo di FAST aggira alcuni dei limiti noti delle metodologie convenzionali di sub-percezione. Le metodologie convenzionali di sub-percezione non richiedono che il paziente senta parestesia, una proprietà apprezzata da alcuni pazienti, ma a costo di alcuni notevoli inconvenienti rispetto alla terapia con parestesia SCS. In primo luogo, a causa del tempo di lavaggio particolarmente lento (ore o giorni), i pazienti lasciano la sessione di programmazione iniziale ancora in attesa di sollievo e possono solo sperare che uno dei programmi loro forniti sia efficace. Allo stesso modo, a causa della mancanza di feedback fisiologico, i medici non hanno la certezza che le derivazioni siano posizionate in modo ottimale o che i programmi funzioneranno. In secondo luogo, il numero di impostazioni del programma verificabili è limitato da considerazioni pragmatiche, mettendo in dubbio se le impostazioni finali, anche se efficaci in una certa misura, siano veramente ottimali. In terzo luogo, in molti casi, i programmi SCS di sub-percezione convenzionali richiedono relativamente più energia rispetto ai programmi basati su parestesie, sebbene lavori recenti indichino che l’alta energia non è una proprietà intrinseca del SCS di sub-percezione.13 , 30 ]. Al contrario, la nostra esperienza nell’utilizzo della nuova metodologia FAST indica che è possibile una valutazione rapida di diverse impostazioni SCS (una proprietà che si è dimostrata utile per ottenere la copertura del dolore-parestesie in SCS tradizionale) e può risultare in un’analgesia efficace durante la sessione di programmazione, riducendo sostanzialmente utilizzo della carica al secondo (95% in meno rispetto all’utilizzo di SCS con sub-percezione convenzionale a 10 kHz [0,88 ± 0,04 mC/s] e 83% in meno rispetto alla terapia a 1 kHz [0,30 ± 0,07 mC/s]) [ 9 ]. Questi dati sono anche coerenti con il lavoro recente che valuta SCS di sottopercezione attraverso lo spettro di frequenza [ 13]. Inoltre, poiché FAST non richiede un posizionamento speciale dell’elettrocatetere, ma utilizza piuttosto lo stesso posizionamento che verrebbe tipicamente utilizzato per la terapia basata su parestesie e altre modalità di sub-percezione ad azione lenta, i pazienti hanno accesso ad altre modalità SCS se ritenute utili o desiderate .
Questo studio ha dei limiti dato il suo design retrospettivo. In primo luogo, tutti i pazienti valutati avevano accesso e/o sperimentato SCS prima dell’inizio dello studio (numero medio di giorni impiantati prima dell’attivazione FAST: 184 giorni), e quindi non era in atto alcuna procedura stabilita per misurare il potenziale dolore basato sul “riporto” sollievo che potrebbe essersi verificato anche dopo l’uso della procedura di targeting neurale guidata da parestesia. Tuttavia, dato che l’entità del sollievo dal dolore è stata mantenuta fino a 3 e 6 mesi di follow-up, la probabilità di un effetto di trascinamento dalla programmazione pre-FAST sembra essere minima. In secondo luogo, non esisteva un protocollo prestabilito per documentare l’esatta misurazione del tempo di “lavaggio” dell’analgesico indotto da FAST, anche se aneddoticamente tutti i pazienti hanno comunicato un rapido raggiungimento del sollievo dal dolore, in pochi minuti. Infine, tutti i pazienti inclusi in questa analisi hanno riportato una sovrapposizione completa (o quasi completa) della parestesia con l’area del dolore mirata. Dai nostri dati non è chiaro se FAST possa essere ancora efficace anche in siti che potrebbero avere solo una parziale sovrapposizione e in circostanze in cui una combinazione di altri programmi aggiuntivi potrebbe essere implementata in modo fattibile.
Sulla base dei risultati riportati in questo studio, sono ora necessari futuri studi clinici su FAST per convalidare e studiare ulteriormente questo nuovo metodo. In particolare, gli studi futuri dovranno essere progettati per misurare specificamente il tempo di insorgenza dell’analgesico indotto da FAST. Inoltre, poiché il targeting, i parametri, il tempo di insorgenza e il consumo di energia di FAST sono molto diversi dagli approcci SCS di sottopercezione convenzionali, è possibile che FAST possa coinvolgere un diverso meccanismo d’azione. In quanto tali, le osservazioni cliniche annotate in questo studio possono aiutare a guidare le future indagini sui parametri e le impostazioni di stimolazione specifici di FAST, incluso il ruolo che il preciso targeting della neurostimolazione può avere sulla trasmissione elettrofisiologica del dolore.
5. Conclusioni
Questo studio osservazionale multicentrico fornisce il primo rapporto di una nuova terapia di subpercezione ad azione rapida (FAST) osservata per indurre un’analgesia rapida e prolungata nei pazienti trattati con SCS per dolore cronico misurato a 3 e 6 mesi o fino a ultimo follow-up dei pazienti. Inoltre, è stato osservato che FAST consente la conferma del sollievo dal dolore all’interno di una singola visita clinica invece della lunga ottimizzazione della programmazione associata alle tecniche convenzionali di sub-percezione. Questo studio indica anche che la neurostimolazione mirata che utilizza una forma d’onda bifasica simmetrica ad alta risoluzione, guidata da parestesie, può essere utilizzata per identificare un target specifico del paziente da utilizzare come marker fisiologico per una terapia senza parestesie. Inoltre, la natura di sub-percezione ad azione rapida della modalità e la potenziale sensibilità spaziale sollevano importanti spunti per quanto riguarda le indagini in corso sui meccanismi d’azione di SCS. Questi risultati forniscono quindi la prova iniziale che FAST costituisce un nuovo approccio nell’erogazione della terapia SCS basata sulla sub-percezione per il trattamento di pazienti con dolore cronico.
Riferimenti Bibliografici
- Melzack R , Muro PD. Meccanismi del dolore: una nuova teoria . Scienza. 1965 ;150(3699 ) : 971-979 . [Crossref] , [PubMed] , [Web of Science ®], [Google Scholar]
- North RB , Ewend MG , Lawton MT , et al. Stimolazione del midollo spinale per dolore cronico e intrattabile: superiorità dei dispositivi “multicanale” . Dolore. 1991 ;44(2): 119 – 130 . [Crossref] , [PubMed] , [Web of Science ®], [Google Scholar]
- Yearwood T , Foster A Un confronto prospettico della stimolazione del midollo spinale (SCS) utilizzando la stimolazione della colonna dorsale (DCS), la stimolazione della radice nervosa intraspinale (INRS) e la larghezza dell’impulso variabile nel trattamento della lombalgia cronica . In: Abstract digitale presentato al 56° meeting annuale del CNS , Chicago , 2006 . [Google Scholar]● Questo è uno dei primi rapporti pubblicati a documentare l’analgesia indotta in pazienti che hanno utilizzato SCS utilizzando intensità di ampiezza al di sotto della soglia di percezione (sotto-soglia).
- Kapural L , Yu C , Doust MW , et al. La nuova terapia ad alta frequenza a 10 kHz (Terapia HF10) è superiore alla tradizionale stimolazione del midollo spinale a bassa frequenza per il trattamento del dolore cronico alla schiena e alle gambe: lo studio randomizzato controllato SENZA-RCT . Anestesiologia. 2015 ;123(4): 851 – 860 . [Crossref] , [PubMed] , [Web of Science ®], [Google Scholar]
- Pintea B , de Boni L , Kinfe TM . Burst subpercezionale contro forme d’onda di stimolazione del midollo spinale tonico percettivo per tremore ortostatico resistente ai farmaci: dati comparativi di 2 casi . Mov Disord Clin Pract. 2017 ;4(4): 612 – 615 . [Crossref] , [PubMed] , [Web of Science ®], [Google Scholar]
- North JM , Hong KJ , Cho PY . Risultati clinici della stimolazione del midollo spinale di sottopercezione di 1 kHz in pazienti impiantati con stimolazione basata su parestesia fallita: risultati di uno studio prospettico randomizzato controllato . Neuromodulazione. 2016 ;19(7): 731 – 737 . [Crossref] , [PubMed] , [Web of Science ®], [Google Scholar]
- Shealy CN , Mortimer JT , Hagfors NR . Elettroanalgesia della colonna dorsale . J Neurochirurgia. 1970 ;32(5): 560 – 564 . [Crossref] , [PubMed] , [Web of Science ®], [Google Scholar]
- Al-Kaisy A , Palmisani S , Smith T , et al. L’uso della stimolazione del midollo spinale a 10 kilohertz in una coorte di pazienti con dolore neuropatico cronico agli arti refrattari alla gestione medica . Neuromodulazione. 2015 ;18(1): 18 – 23 . [Crossref] , [PubMed] , [Web of Science ®], [Google Scholar]
- Thomson SJ , Tavakkolizadeh M , Love-Jones S , et al. Effetti del tasso sull’analgesia nella stimolazione del midollo spinale a frequenza kilohertz: risultati dello studio randomizzato controllato PROCO . Neuromodulazione. 2018 ;21(1): 67 – 76 . [Crossref] , [PubMed] , [Web of Science ®], [Google Scholar]● Questa indagine controllata ha fornito la conferma finale che 10 kHz non sono necessari per ottenere un efficace sollievo dal dolore quando si utilizza SCS al di sotto della soglia di percezione e che quando si utilizzano frequenze inferiori a 10 kHz è possibile conservare una quantità significativa di energia del dispositivo, riducendo così il carico il paziente si ricarichi più frequentemente quando utilizza una modalità di neurostimolazione terapeutica sub-percettiva.
- Lee KY , Bae C , Lee D , et al. La stimolazione del midollo spinale a bassa intensità e frequenza kilohertz colpisce in modo diverso i neuroni eccitatori e inibitori nel corno dorsale superficiale del roditore . Neuroscienza. 2020 ;428: 132 – 139 . [Crossref] , [PubMed] , [Web of Science ®], [Google Scholar]
- Chakravarthy K , Richter H , Christo PJ , et al. Stimolazione del midollo spinale per il trattamento del dolore cronico: revisione dei dati preclinici e clinici sulla terapia ad alta frequenza senza parestesie . Neuromodulazione. 2018 gennaio ;21(1): 10 – 18 . [Crossref] , [PubMed] , [Web of Science ®], [Google Scholar]
- Linderoth B , caposquadra RD . Algoritmi di stimolazione spinale convenzionali e nuovi: ipotetici meccanismi d’azione e commenti sugli esiti . Neuromodulazione. 2017 ;20(6): 525 – 533 . [Crossref] , [PubMed] , [Web of Science ®], [Google Scholar]
- Paz-Solis J , Thomson S , Jain R , et al. Esplorazione delle opzioni ad alta e bassa frequenza per la stimolazione del midollo spinale sotto-percezione utilizzando le relazioni dei parametri di dosaggio neurale: lo studio HALO. Neuromodulazione. [In stampa]. [Google Scholar]● Questo studio ha dimostrato che un nuovo algoritmo, configurato per produrre una forma di campo elettrico progettata per impegnare preferenzialmente il corno dorsale utilizzando la programmazione della sub-percezione, può essere efficacemente ottenuto a frequenze sub-kHz comprese tra 10 e 1000 Hz secondo un criterio stabilito empiricamente relazione tra parametri di stimolazione, denominata “dosaggio neurale”. In quanto tale, l’implicazione chiave di questo studio è che l’uso più efficace della terapia della sub-percezione non si ottiene regolando da solo un parametro di stimolazione (cioè frequenza o larghezza o ampiezza dell’impulso).
- Feirabend HK , Choufoer H , Ploeger S , et al. Morfometria delle fibre della colonna dorsale e dorsolaterale superficiale umana: significato per la stimolazione del midollo spinale . Cervello. 2002 ;125(Pt 5): 1137 – 1149 . [Crossref] , [PubMed], [Google Scholar]
- Veizi E , Hayek SM , North J , et al. La stimolazione del midollo spinale (SCS) con targeting neurale anatomicamente guidato (3D) mostra un sollievo dal dolore lombare assiale cronico superiore rispetto allo studio SCS-LUMINA tradizionale . Dolore Med. 2017 ;18(8): 1534 – 1548 . [PubMed] , [Web of Science ®], [Google Scholar]
- Bradley K. _ La tecnologia: l’anatomia di uno stimolatore del midollo spinale e della radice nervosa: l’elettrocatetere e la fonte di alimentazione . Dolore Med. 2006 ;7(s1): S27 – S34 . [Rif incrociato], [Google Scholar]
- Oakley JC , Prager JP . Stimolazione del midollo spinale: meccanismi d’azione . Colonna vertebrale (Phila Pa 1976). 2002 ;27(22): 2574 – 2583 . [Crossref] , [PubMed] , [Web of Science ®], [Google Scholar]
- Sdrulla AD , Guan Y , Raja SN . Stimolazione del midollo spinale: efficacia clinica e potenziali meccanismi . Pratica del dolore. 2018 ;18(8): 1048 – 1067 . [Crossref] , [PubMed] , [Web of Science ®], [Google Scholar]
- Jensen MP , Brownstone RM . Meccanismi di stimolazione del midollo spinale per il trattamento del dolore: ancora all’oscuro dopo 50 anni . Eur J Pain. 2019 ;23(4): 652 – 659 . [Crossref] , [PubMed] , [Web of Science ®], [Google Scholar]
- Ji RR , chamessiano A , Zhang YQ . Regolazione del dolore da parte di cellule non neuronali e infiammazione . Scienza. 2016 ;354(6312): 572 – 577 . [Crossref] , [PubMed] , [Web of Science ®], [Google Scholar]
- Fan W , Sdrulla AD . Modulazione differenziale delle popolazioni eccitatorie e inibitorie dei neuroni del corno dorsale superficiale nel midollo spinale lombare mediante stimolazione elettrica con fibre Aβ . Dolore. 2020 ;161(7): 1650 – 1660 . [Crossref] , [PubMed] , [Web of Science ®], [Google Scholar]● Questo studio fornisce dati a supporto di un modello secondo il quale la stimolazione adiacente (cioè dal/i campo/i recettivo/i “circondato/i”) alla radice nervosa corrispondente alla fonte del dolore può essere più vantaggiosa rispetto al targeting diretto del/i dermatomo/i doloroso/i. Inoltre, questo documento suggerisce che l’inibizione a lungo termine, dell’ordine di minuti o ore, può verificarsi come risultato della plasticità neurale indotta dalla stimolazione elettrica delle fibre Aβ dai dermatomi circostanti.
- Lee KY , Ratté S , Prescott SA . I neuroni eccitatori sono più disinibiti dei neuroni inibitori dalla disregolazione del cloruro nel corno spinale dorsale . Elife. 2019 ;8: e49753 . [Crossref] , [PubMed] , [Web of Science ®], [Google Scholar]
- Zhang TC , Janik JJ , Grill WM . Modellazione degli effetti della stimolazione del midollo spinale sui neuroni del corno dorsale ad ampia gamma dinamica: influenza della frequenza di stimolazione e dell’inibizione GABAergica . J Neurophysiol. 2014 ;112(3): 552 – 567 . [Crossref] , [PubMed] , [Web of Science ®], [Google Scholar]
- Gilbert JE , Titus ND , Zhang TC , et al. “La modellazione computazionale prevede che le colonne dorsali siano coinvolte nella stimolazione del midollo spinale sub-percezionale ad azione rapida (SCS)” [Abstract P166.01] . Society for Neuroscience Global Connectome: un evento virtuale , 11–13 gennaio 2021 . [Google Scholar]● Questo recente rapporto, basato su un’analisi che utilizza un modello computazionale, suggerisce che i parametri di stimolazione FAST in combinazione con un preciso targeting spaziale della neurostimolazione diretta al campo o ai campi ricettivi appropriati sono probabilmente importanti per l’efficace induzione di “inibizione del surround” tramite il attivazione selettiva delle fibre della colonna dorsale provenienti da posizioni anatomiche immediatamente circostanti il campo ricettivo doloroso, che di conseguenza si traduce in una robusta soppressione dell’attività dei neuroni Wide Dynamic Range (WDR).
- Wolter T , Kiemen A , Porzelius C , et al. Effetti della stimolazione del midollo spinale della soglia di sub-percezione nel dolore neuropatico: uno studio crossover randomizzato controllato in doppio cieco . Eur J Pain. 2012 ;16(5): 648 – 655 . [Crossref] , [PubMed] , [Web of Science ®], [Google Scholar]
- Kent AR , Weisshaar CL , Venkatesan L , et al. La stimolazione del midollo spinale burst e ad alta frequenza ha un effetto differenziale sull’attività neuronale spinale dopo la radicolopatia . Ann Biomed Ing. 2020 ;48(1): 112 – 120 . [Crossref] , [PubMed] , [Web of Science ®], [Google Scholar]
- De Carolis G , Paroli M , Tollapi L , et al. Indipendenza da parestesia: una valutazione dei fattori tecnici relativi alla stimolazione del midollo spinale senza parestesie a 10 kHz . medico del dolore. 2017 ;20(4): 331 – 341 . [PubMed] , [Web of Science ®], [Google Scholar]
- Yearwood TL , Hershey B , Bradley K , et al. Programmazione dell’ampiezza dell’impulso nella stimolazione del midollo spinale: uno studio clinico . medico del dolore. 2010 ;13(4): 321 – 335 . [Crossref] , [PubMed] , [Web of Science ®], [Google Scholar]● Questo studio ha dimostrato che il beneficio clinico è stato ottenuto attraverso la modulazione della larghezza dell’impulso nei pazienti che utilizzavano SCS per il dolore cronico, consentendo una migliore sovrapposizione della parestesia con l’area del dolore e ha anche dimostrato che questa regolazione ha consentito una maggiore capacità di guidare la parestesia e fornire più copertura.
- Lee D , Hershey B , Bradley K , et al. Effetti previsti della programmazione dell’ampiezza dell’impulso nella stimolazione del midollo spinale: uno studio di modelli matematici . Med Biol Eng Comput. 2011 ;49(7): 765 – 774 . [Crossref] , [PubMed] , [Web of Science ®], [Google Scholar]
- Vesper J , Slotty P , Schu S , et al. Il microdosaggio Burst SCS è efficace quanto lo standard Burst SCS nel trattamento del dolore cronico alla schiena e alle gambe: risultati di uno studio randomizzato controllato . Neuromodulazione. 2019 ;22(2): 190 – 193 . [Crossref] , [PubMed] , [Web of Science ®], [Google Scholar]